临床试验机构
感谢您选择厦门市仙岳医院临床试验机构合作,为保证临床试验的项目质量,规范临床试验的顺利运行,请配合我们的工作并做到以下几点:
机构相关信息:
办公电话:0592-5392571
临床试验系统网址:http://121.204.151.245:20070/
工作时间:8:00-12:00、14:30-17:30
地点:福建省厦门市思明区仙岳路387-399号门诊四楼475
试验项目的承接范围:药物注册项目(精神科-精神病专业)、医疗器械项目(精神科-精神病专业)、药品上市后再评价项目、研究者发起的临床研究(企业资助)
机构人员分工:
项目意向洽谈:廖震华、邹晨婷
项目立项审核:邹晨婷
合同签署:廖震华
经费管理:连雯霞、廖震华
药物管理:陈 政、周义湘
机构质控:陈 杨、吕海燕
资料管理:连雯霞、邹晨婷
一、项目立项流程
1.意向沟通:若有意向PI,申办方/CRO公司人员与本中心意向PI联系,进行意向沟通,若无意向PI,可发送方案摘要到机构办邮箱(gcpxianyue2019@163.com),由机构办协助推荐PI。
2.立项申请:
(1)申请临床试验请按照不同类别的项目立项资料清单(药物/医疗器械/IIT类)准备资料,电子版初稿发送至机构邮箱(gcpxianyue2019@163.com)审核。
(2)线下审核:电子版立项通过后,电子版立项资料相对应的纸质立项资料1套(使用二孔文件夹装订,文件夹侧面写上项目名称、申办方、CRO、科室、PI等内容)递交至机构办。
二、协议签订
1. 项目立项成功后,即可进行合同洽谈(可与伦理审查同步进行)。
2. 为加快合同签署的进度,原则上使用机构提供的合同模板。
3. 申办方/CRO相关人员在网盘中下载主协议合同模板及CRC服务三方协议模板(药物/医疗器械/IIT类三种类型的主协议模板,项目涉及到CRO公司时,主协议需要申办方、CRO公司和机构共同签署,具体事务请咨询机构办)。
4. 申办方/CRO相关人员根据合同模板拟订合同,发邮件到机构邮箱进行合同事务沟通。
5. 机构办公室确认定稿的合同后,发邮件告知申办方/CRO相关人员,同时进行院内OA合同审核(预计一周内完成)。
6.申办方/CRO相关人员双面打印合同定稿,将申办方/CRO签字签日期、CRC服务三方协议含SMO签字签日期、盖章及PI签字的合同数份交给机构办公室。(待取得伦理批件后,方可正式签署合同,合同签署日期必须晚于伦理批准时间)
7. 为减少不必要的问题出现,请认真查看机构网盘中合同签署注意事项。
三、经费管理
1. 申办方向医院支付临床试验经费时,应简要注明项目名称和费用用途;在机构备案的CRA在CTMS系统上提交入账申请,并将转账凭证上传CTMS系统;再将纸质《临床试验费用入账通知单》及转账凭证递交至机构办,即可开具正规票据,无特殊情况下,开电子专票。
2. 收到伦理审查会议通知后,请尽快支付伦理审查费,转账凭证是伦理委员会会议审查的前提条件。
3. 所有试验经费均须转入医院账户(单位名称:厦门市仙岳医院;开户银行:农行厦门松柏支行;对公账号:40347001040001703),不得转入研究者私人账户。
4.档案管理费:免费保存至项目结束后5年,免费年限到期后,收取一定的资料管理费。
四、启动会筹备
1. 伦理审查通过、签订合同、遗传办事宜(如有)完成后,即可准备启动会召开事宜。
2. 启动会前根据合同原则上要求支付研究首付款。
3. 药物、医疗器械、试验物资在启动会前到位,药物、医疗器械到位前需要联系药物或医疗器械管理员进行药物/医疗器械管理相关表格审核及培训授权。
4. 文件受控:受控流程详见机构网盘文件。
5、启动前质控:与机构质控员提前联系进行启动前质控相关事宜,所有事情完成后方可预约启动时间。
五、启动会召开
启动会筹备、文件受控完成后,请分别与PI及机构办公室预约启动会召开时间。并在两周内将所有已签字的启动会相关表格(如:培训签到表、授权表等)递交机构办。
六、试验运行过程要求
1. CRA原则上每个月监查一次,并提前在CTMS系统进行预约。
2.试验期间,对试验方案、知情同意书、招募广告等文件资料的修正案,请按照伦理委员会要求递交相关材料进行伦理审查。
3.按照伦理审查批件规定的年度/定期跟踪审查频率,在截止日期前1个月提交研究进展报告。当出现任何可能显著影响研究进行、或增加受试者风险的情况时,应以“研究进展报告”的方式及时报告伦理委员会。
4.终止试验项目需告知主要研究者、机构办公室、伦理委员会,一式两份提交“临床试验终止通知函(加盖公章)”及“药物临床试验暂停或终止研究报告申请”。
5.试验期间或结束后,申办方需要对项目进行自查时,自查人员提前跟机构预约时间,并提供公司派遣函及自查人员相关备案资料。
6.本机构对临床试验质量实行两级质控。
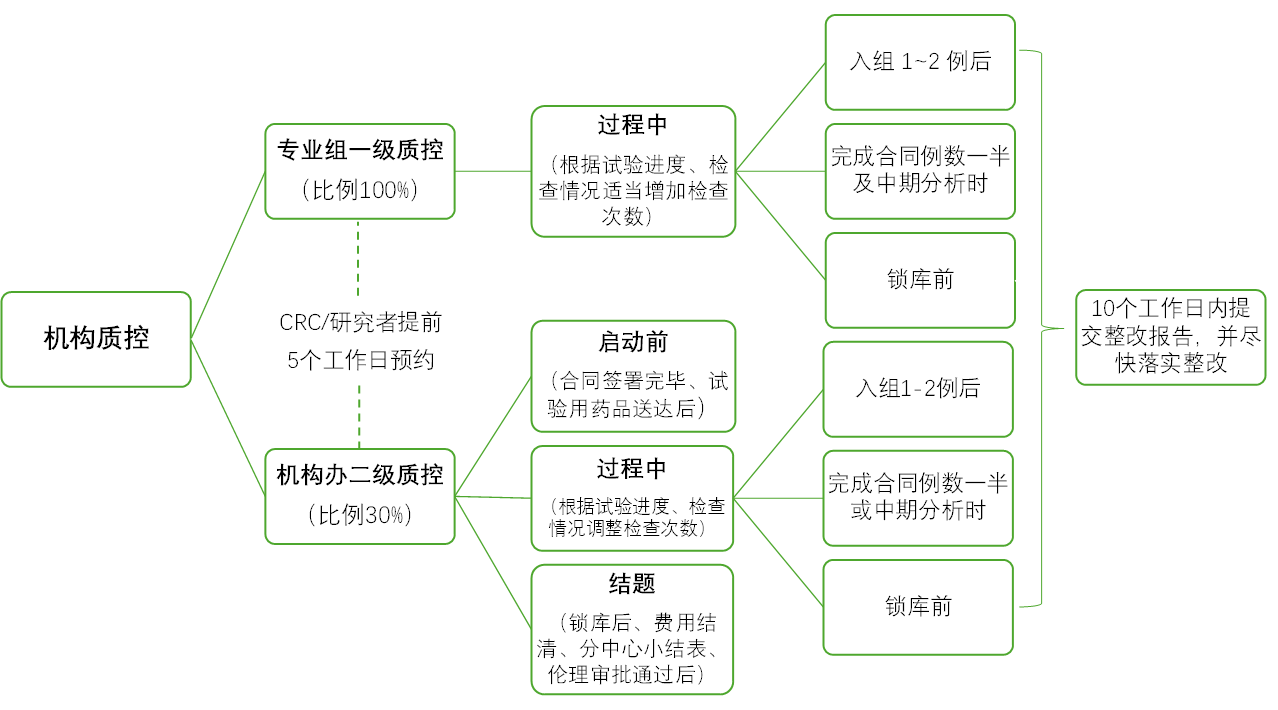
药企发起的临床试验(IST)质控模式
注:研究者发起的临床研究(IIT)中,其中观察性研究,原则上不质控。干预性研究,定期质控,一般按照IST进行管理。
七、试验药物管理须知
1.试验药物由机构GCP药房统一接收管理。
2.申办方递送药品前,请与药物管理员提前沟通联系。(详细请参照机构网盘文件《机构药房注意事项》)。
3.温度记录:GCP药房采取电子温湿度监控系统进行温湿度监控,如果需要相关所有数据时,请提前与药物管理员联系,打印并签字。
4.涉及住院受试者项目时,请提供转运箱;涉及需要使用恒温箱、8-20℃冰箱时,请提供干燥剂。
5.具体事务要求参照机构网盘信息。
八、试验项目的结题要求
1.及时向伦理委员会提交结题报告、分中心小结或研究总结报告,并通过结题审查。
2.试验用药品/器械、物资交接。
(1) 申办者发送《临床试验用药品/医疗器械回收告知函》至机构办邮箱,并抄送给药品/医疗器械管理员。
(2) 申办者、药品/医疗器械管理员待收到机构办的电子回执后,方可回收试验用药品/器械,具体回收工作按照《临床试验用药品/医疗器械管理的标准操作规程》执行。
(3) 机构办秘书确认试验用药品/医疗器械,所有未使用/剩余的物品、文件已退还至申办者并完成《临床试验物资交接表》。
3.按照协议条款,提交合同复印件、受试者补贴发放表复印件、费用结算清单(清单要求列出每个病例的受试者补贴、检验检查费、研究者观察费等,经机构办、PI审核无误,PI签字确认后交至机构办公室),将所有试验费用结清。
4.中心小结报告提交2份(原件)或总结报告提交2份(原件)。
5.务必抽出时间,现场配合机构办公室按照“临床试验资料归档目录”完成资料归档。
